La química orgánica es la disciplina científica que estudia la estructura, propiedades, síntesis y reactividad de compuestos químicos formados principalmente por carbono e hidrógeno, los cuales pueden contener otros elementos, generalmente en pequeña cantidad como oxígeno, azufre, nitrógeno, halógenos, fósforo, silicio.
El término “orgánico” procede de la relación existente entre estos compuestos y los procesos vitales, sin embargo, existen muchos compuestos estudiados por la química orgánica que no están presentes en los seres vivos, mientras que numerosos compuestos inorgánicos forman parte de procesos vitales básicos, sales minerales, metales como el hierro que se encuentra presente en la hemoglobina.
Los compuestos orgánicos presentan una enorme variedad de propiedades y aplicaciones y son la base de numerosos compuestos básicos en nuestras vidas, entre los que podemos citar: plásticos, detergentes, pinturas, explosivos, productos farmacéuticos, colorantes, insecticidas, etc.
Átomo del Carbono
El carbono es un elemento químico de número atómico 6 y símbolo C. Es sólido a temperatura ambiente. Dependiendo de las condiciones de formación, puede encontrarse en la naturaleza en distintas formas alotrópicas, carbono amorfo y cristalino en forma de grafito o diamante. Es el pilar básico de la química orgánica; se conocen cerca de 10 millones de compuestos de carbono, y forma parte de todos los seres vivos conocidos.
Características
El carbono es un elemento notable por varias razones. Sus formas alotrópicas incluyen, sorprendentemente, una de las sustancias más blandas (el grafito) y la más dura (el diamante) y, desde el punto de vista económico, uno de los materiales más baratos (carbón) y uno de los más caros (diamante). Más aún, presenta una gran afinidad para enlazarse químicamente con otros átomos pequeños, incluyendo otros átomos de carbono con los que puede formar largas cadenas, y su pequeño radio atómico le permite formar enlaces múltiples.

Las Propiedades de Enlace del Carbono
Los enlaces carbono-carbono son inusualmente fuertes, por lo que el carbono puede formar un esqueleto estable y resistente para una molécula grande. Sin embargo, tal vez lo más importante es su capacidad de formar enlaces covalentes. Dado que un átomo de C puede formar enlaces covalentes hasta con otros cuatro átomos, es bastante adecuado para formar el esqueleto básico de una macromolécula.
La capacidad del carbono para formar enlaces con otros cuatro electrones se debe a su número y configuración de electrones. El carbono tiene un número atómico de seis (esto es, seis protones y seis electrones en un átomo neutro), así que los primeros dos electrones llenan la capa interna y los cuatro restantes se quedan en la segunda capa, que es la capa de valencia (la más externa). Para lograr la estabilidad, el carbono debe encontrar cuatro electrones más para llenar su capa externa, para un total de ocho que cumple con la regla del octeto. Los átomos de carbono pueden entonces formar enlaces con otros cuatro átomos.
Por ejemplo, en el metano (CH₄), el carbono forma enlaces covalentes con cuatro átomos de hidrógeno. Cada enlace corresponde a un par de electrones compartidos (uno del carbono y otro del hidrógeno), lo que le da al carbono los ocho electrones que necesita para llenar su capa externa.
Enlaces del Carbono
Hay tres tipos de enlaces carbono: los enlaces sencillos C-C, los dobles C=C, y los triples C≡C. Cuando en un compuesto orgánico todos los enlaces C-C son sencillos, la cadena de átomos de C adopta una forma tetraédrica y el C utiliza 4 orbitales sp3.
Si el compuesto posee dobles enlaces C=C la estructura de la molécula es plana y el C utiliza 3 orbitales híbridos sp2. El C=C se produce por una solapación frontal σ sp2-sp2 y otra lateral πy fruto de la solapación de los 2 orbitales py que no han participado en la hibridación.
Si el enlace es triple C≡C, el átomo de C utiliza 2 orbitales híbridos sp; del triple enlace, uno es σ sp-sp; y los otros dos π, πy y πz por solapación lateral de los 2 orbitales 2 py y 2pz respectivamente.
Los compuestos cíclicos pueden ser carbocíclicos cuando todos los átomos que intervienen en el ciclo son átomos de carbono y heterocíclicos cuando intervienen además del C otros átomos.
Formas Alotrópicas del Carbono
El carbono es sólido a temperatura ambiente, y según la forma en la que se haya formado, presenta en la naturaleza diferentes formas, conocidas como formas alotrópicas.
En la alotropía del carbono, se conocen tres formas, sin contar con el carbono amorfo, y son: grafito, diamante, fullerenos.
Grafito
El grafito posee una estructura laminar (como se puede observar en la figura), las láminas están separadas por capas, y cada capa tiene una separación entra ellas de 3.35 Å, que se corresponde a la suma de los radios de Van der Waals, lo que nos indica que las fuerzas entre las capas debe de ser relativamente débil. Este hecho nos indica la blandura del grafito, así como las propiedades lubricantes, que se suele atribuir al deslizamiento de una capa sobre la otra.
Los objetos que se comercializan fabricados en fibra de carbono, se producen al pirolizar las fibras de los polímeros orgánicos.
El grafito tiene hoy en día diversas aplicaciones, en la fabricación de lápices, debido a la buena conducción de la electricidad y el calor, también se utiliza el grafito para revestir los moldes de galvanoplastia, para poder fabricar crisoles o moldes que serán sometidos a altas temperaturas. También se usa para evitar las oxidaciones, y en los últimos tiempos, es considerado como un buen mineral para la construcción de armamento nuclear, debido a su uso para reducir la acción de neutrones de uranio.
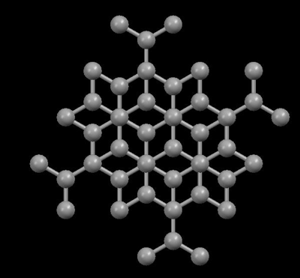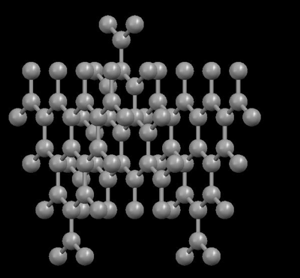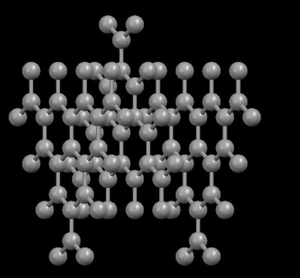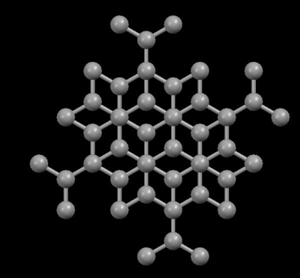
Fullereno
Se forman cuando el grafito se vaporiza en un láser. Esta es una variedad de grupos, grandes que tienen un núcleo constante de átomos de carbono. Se denomina fullereno a dicho agrupamiento de átomos, siendo el más famoso el conocido como C60.
Fue descubierto en 1985 por H. Kroto, cuando intentaba estudiar la estructura de una molécula de carbono, misteriosa hasta el momento, que existe en el espacio exterior.
La investigación demostró que un modelo de 60 átomos, era más fuerte y estable que el resto, cosa inexplicable en aquel momento. La búsqueda de respuestas sugirió, que los átomos se colocaban en forma de esfera formando hexágonos y pentágonos, haciendo recordar a la forma de la cúpula del arquitecto Richard Buckminster Fuller, de ahí que se les de el nombre de Fullerenos.
Una curiosa característica es el hecho de que los hexágonos y pentágonos coinciden siempre en 60 puntos, configurando un aspecto de balón de futbol, y es por ello que también se les conocen con el nombre de futbolano. Desde que fueron descubiertos, los fullerenos se han investigado rápidamente, avanzando mucho en su conocimiento.
Gracias al diámetro interno del carbono, los fullerenos pueden alojar en su interior diferentes iones pequeños como los de helio, potasio, etc, existiendo también la posibilidad de que otros átomos se fijen al interior o exterior de las esferas, posibilitando la obtención de compuestos con propiedades fisicoquímicas bastante útiles, como el KC60, que es un buen superconductor.

Diamante
El diamante tiene una estructura de cristal covalente tridimensional, que se encuentra formado por enlaces C-C interconectados, extendiéndose a través de todo el cristal, por lo que se dice que el diamante es una molécula gigante. La estructura cristalina, es cúbica y se encuentra centrada en la cada, a dicha estructura se la conoce comúnmente como red de diamante.
Es uno de los sólidos más duros que se conocen, y posee además una alta densidad, e índice de refracción, siendo la segunda forma alotrópica del carbono más estable (la primera es el grafito).
Su característica principal es la dureza ( resistencia a la rayadura), propiedad que permite su aplicación fundamentalmente en herramientas de pulido o de corte. Gracias a la estructura característica, la cual es bastante rígida, es difícil la contaminación con impurezas. El diamante es sin duda la piedra preciosa más popularmente conocida, gracias a sus propiedades ópticas, transparencia, dureza, etc.
El diamante sólo se puede obtener partiendo del carbono grafito, sometiéndolo a altas presiones y altas temperaturas. La identificación de los diamantes se realiza a través de su alta conductividad eléctrica, o el índice de refracción. Los diamantes tienen una industria con dos ramas, una la dedicada al diamante a modo de piedra preciosa, y otra industrial.

Estructura de Lewis
Estructura de Lewis, también llamada diagrama de punto, modelo de Lewis o representación de Lewis, es una representación gráfica que muestra los enlaces entre los átomos de una molécula y los pares de electrones solitarios que puedan existir.
Esta representación se usa para saber la cantidad de electrones de valencia de un elemento que interactúan con otros o entre su misma especie, formando enlaces ya sea simples, dobles, o triples y estos se encuentran íntimamente en relación con los enlaces químicos entre las moléculas y su geometría molecular, y la distancia que hay entre cada enlace formado.
La Resonancia
La Resonancia (denominado también Mesomería) en química es una herramienta empleada (predominantemente en química orgánica) para representar ciertos tipos de estructuras moleculares. La resonancia consiste en la combinación lineal de estructuras de una molécula (estructuras resonantes) que no coinciden con la estructura real, pero que mediante su combinación, nos acerca más a su estructura real.

Fernández. G, (S.F), ¿Que es la Química Orgánica?, http://www.quimicaorganica.org/component/content/article/30/56-que-es-la-quimica-organica.html
https://quimica.fandom.com/wiki/Carbono
https://es.khanacademy.org/science/biology/properties-of-carbon/carbon/a/carbon-and-hydrocarbons

Comentarios
Publicar un comentario