Hidrocarburos alifáticos saturados
Responden a la fórmula general CnH2n+2, donde n es el número de átomos de carbono. Se nombran según el número de átomos de carbono de la cadena, terminados en -ano. Se dividen en: alcanos y cicloalcanos.
⇝ Alcanos
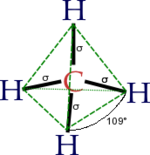
Los alcanos son los hidrocarburos (compuestos de C e H) más simples, no tienen grupo funcional y las uniones entre átomos de carbono (con hibridación sp3) son enlaces simples, cada orbital se dirige a los vértices de un tetraedro. Cada orbital forma un enlace σ con cada H.
PROPIEDADES DE LOS ALCANOS
⇢ El estado fisico de los primeros cuatro alcanos: metano, etano, propano, butano es gaseoso.
⇢ Del pentano al hexadecano son liquidos y a partir del heptadecano son solidos.
⇢ El punto de fusion, de ebullicion y la densidad aumentan conforme el numero de atomos de carbono.
⇢ Pueden emplearse como disolventes para sustancias poco polares como grasas, aceites y ceras.
⇢ Son insolubles en agua.
⇢ El gas de uso domestico es una mezcla de alcanos, principalmente propano.
⇢ El gas de los encendedores es butano.
⇢ El principal uso de los alcanos es como combustibles debido a la gran cantidad de calor que se libera en esta reaccion:
CH₄ + 2O₂ → CO₂ + 2H₂O + calor
⇝ Nomenclatura de los Hidrocarburos Saturados o Alcanos
- Nombre del alcano: Se le coloca un prefijo según el número de carbonos más el sufijo -ano.
1. Elección de la cadena principal.
1.1 Se elige la cadena de mayor numero de átomos de carbono.
1.2 Aquella de mayor numero de cadenas laterales.
1.3 Aquella de cadenas laterales con localizadores o posiciones mas bajas.
1.4 Aquella de mas carbonos en la cadena lateral mas pequeña.
2. La Numeracion.
2.1 Numeros mas bajos a los sustituyentes.
2.2 Numeros mas bajos a los sustituyentes por orden alfabetico.
3. El Nombre.
3.1 Se anteponen los nombres de los sustituyentes por orden alfabético acompañados de su localizador o posicion.
3.2 Sustituyentes repetidos en el mismo u otro carbono repiten el numero y utilizan prefijos multipicativos (di, tri, tetra, etc).
3.3 Los prefijos multiplicativos (di, tri, tetra, etc) no se alfabetizan.
3.4 Los prefijos n-, sec-, terc-, no se alfabetizan.
3.5 Los prefijos iso, neo y ciclo si se alfabetizan y se escriben sin guion.
3.6 Para nombrar a los radicales ramificados se aplican las siguientes reglas:
▪️ El C1 es el unido a la cadena principal.
▪️Los localizadores se escriben con primas o junto con el nombre del sustituyente entre parentesis.
▪️ Se alfabetiza el prefijo multiplicador del radical sencillo.
▪️Cuando hay varios radicales complejos se utiliza: bis, tris, tetrakis, etc. sin alfabetizar.
EJEMPLOS DE ALCANOS
Existen unos pocos radicales que tienen nombres particulares:
3,4,4-trimetil-5-isobutildecano
⇝ Cicloalcanos
Son hidrocarburos saturados, cuyo esqueleto es formado únicamente por átomos de carbono unidos entre ellos con enlaces simples en forma de anillo. Su fórmula genérica es CnH2n. Su reactividad (con excepción de los anillos muy pequeños ciclopentano y ciclobutano) es casi equivalente a la de los compuestos de cadena abierta. Para nombrarlos se antepone el prefijo ciclo- al nombre del alcano
de igual número de carbonos.

PROPIEDADES FISICAS
• Presentan serie homóloga: difieren en una unidad
constante.
• A temperatura ambiente y a una atmósfera, los cuatro
primeros son gases, del C5 al C16 son líquidos, del C17 y
más son sólidos.
• Los puntos de ebullición aumentan al aumentar la
cadena.
• Los puntos de fusión aumentan levemente (par o impar).
• Son menos densos de todos los grupos de moléculas
orgánicas.
• Insolubles en agua, se disuelven en solvente de baja
polaridad.
PROPIEDADES QUÍMICAS
• Falta de reactividad.
• No son atacados por ácidos o por agentes oxidantes
enérgicos, o agentes reductores.
• Son atacados por el oxígeno a elevadas temperaturas.
• Se descomponen por temperaturas altas en ausencia de
oxígeno.
• Sufren reacciones de halogenación.
• PIROLISIS: Se efectúa la escisión de alcanos de peso
molecular grande en moléculas de menor tamaño.
Estereoquímica de los Alcanos
⇝ Análisis Conformacional y Proyecciones de Newman
Equilibrio Conformacional
Se puede transformar un confórmero en otro mediante la rotación en torno a enlaces simples, lo que no es posible
en los esteroisómeros donde es necesario romper enlaces para transformar uno en otro.
EJEMPLO DEL ETANO
Los diversos rotámeros del etano no poseen la misma energía potencial.
⇝ Al girar un grupo metilo alrededor del eje C-C, empezando a partir de la conformación alternada,
la distancia entre los hidrógenos disminuye, dando lugar a un aumento en la repulsión entre los
pares enlazantes de los enlaces C-H.
⇝ En el punto de eclipse, la molécula tiene su contenido máximo de energía.
⇝ El cambio de energía asociado a la rotación alrededor del un enlace se llama energía rotacional o
torsional.
⇝ En este caso la superficie de energía potencial (SEP) es una función sinusoidal de periodo 120º y
de amplitud 2.9 kcal/mol.
Diagrama de energía potencial de la rotación libre del etano
EJEMPLO DEL PROPANO
⇝ Es un sistema parecido al etano solo que se sustituye un hidrógeno por un
metilo.
⇝ En este caso también las formas extremas son las alternadas y la eclipsadas.
⇝ La barrera en este caso es mayor que en el etano debido al impedimento estérico que
en este caso involucra un metilo y un hidrógeno.
⇝ La variación es sinusoidal porque tenemos el mismo efecto en cada giro.
Tensión de Anillo de un Ciclobutano
La tensión de anillo de un ciclobutano plano se debe a dos factores: la tensión
angular debida a la compresión de los ángulos de enlace desde el ángulo
tetraédrico de 109,5º hasta 90º, y la tensión torsional debida al eclipsamiento de
los enlaces C-H. La compresión para el butano es 19,5º. La tensión angular y la tensión torsional
explican la alta reactividad de los anillos de cuatro átomos de carbono.
Proyección de Newman del Ciclobutano Plano
Conformaciones del Ciclohexano
La conformación de
barca simétrica del
ciclohexano, el
eclipsamiento de los
enlaces da lugar a tensión
torsional. En la molécula
representada, la barca se
retuerce y se forma la barca
torcida, una conformación
con los enlaces menos
eclipsados y con menor
interacción entre los dos
hidrógenos mástil.
Proyeccion de Newman
BARCA SIMÉTRICA BARCA TORCIDA
⇝ El análisis conformacional del ciclohexano indica que las barreras del potencial son
mayores y por lo tanto les podemos medir fácilmente en comparación con las otras
familias.
⇝ El confórmero silla es el más estable.
⇝ Las otras conformaciones bote y twist (bote retorcido) son menos estables.
https://www.ecured.cu/Hidrocarburos_Alif%C3%A1ticos_C%C3%ADclicos_y_Arom%C3%A1ticos#Hidrocarburos_alif.C3.A1ticos
Colocar ejercicios de alcanos
ResponderBorrar